A. PENGERTIAN REDUKSI OKSIDASI
Pengikatan Oksigen :

Pelepasan dan Penerimaan Elektron
 Pada
reaksi tersebut, enam elektron dilepaskan oleh dua atom besi
dan diterima oleh tiga atom oksigen membentuk senyawa Fe2O3, Oleh karena
itu, peristiwa oksidasi selalu disertai peristiwa reduksi. Pada setiap
persamaan reaksi, massa dan muatan harus setara antara ruas
kanan dan ruas kiri (ingat kembali penulisan persamaan reaksi).
Persamaan reaksi redoks tersebut memiliki muatan dan jumlah atom yang
sama antara ruas sebelah kiri dan sebelah kanan persamaan reaksi.
Oksidasi besi netral melepaskan elektron yang membuatnya
kehilangan muatan. Dengan menyamakan koefisiennya maka muatan
pada kedua ruas persamaan reaksi menjadi sama. Penyetaraan pada
reaksi reduksi oksigen juga menggunakan cara yang sama.
Pada
reaksi tersebut, enam elektron dilepaskan oleh dua atom besi
dan diterima oleh tiga atom oksigen membentuk senyawa Fe2O3, Oleh karena
itu, peristiwa oksidasi selalu disertai peristiwa reduksi. Pada setiap
persamaan reaksi, massa dan muatan harus setara antara ruas
kanan dan ruas kiri (ingat kembali penulisan persamaan reaksi).
Persamaan reaksi redoks tersebut memiliki muatan dan jumlah atom yang
sama antara ruas sebelah kiri dan sebelah kanan persamaan reaksi.
Oksidasi besi netral melepaskan elektron yang membuatnya
kehilangan muatan. Dengan menyamakan koefisiennya maka muatan
pada kedua ruas persamaan reaksi menjadi sama. Penyetaraan pada
reaksi reduksi oksigen juga menggunakan cara yang sama.
 Dari
persamaan tersebut, dapat diketahui bahwa Mg melepaskan elektron dan Cl
menerima elektron. Dengan demikian, Mg mengalami oksidasi dan Cl
mengalami reduksi.
Dari
persamaan tersebut, dapat diketahui bahwa Mg melepaskan elektron dan Cl
menerima elektron. Dengan demikian, Mg mengalami oksidasi dan Cl
mengalami reduksi.

Pengikatan Oksigen :
Senyawa yang terbentuk dari hasil reaksi
dengan oksigen dinamakan oksida sehingga reaksi antara oksigen dan
suatu unsur dinamakan reaksi oksidasi. Karat besi adalah senyawa
yang terbentuk dari hasil reaksi antara besi dan oksigen (besi
oksida). Perkaratan besi merupakan salah satu contoh dari reaksi
oksidasi. Persamaan reaksi pembentukan oksida besi dapat ditulis
sebagai berikut.
Pada reaksi tersebut, besi mengalami
oksidasi dengan cara mengikat oksigen menjadi besi oksida. Kebalikan
dari reaksi oksidasi dinamakan reaksi reduksi. Pada reaksi reduksi
terjadi pelepasan oksigen. Besi oksida dapat direduksi dengan
cara direaksikan dengan gas hidrogen, persamaan reaksinya:
Pelepasan dan Penerimaan Elektron
Dalam konsep redoks, peristiwa pelepasan
elektron dinamakan oksidasi, sedangkan peristiwa penerimaan elektron
dinamakan reduksi. Reaksi redoks pada peristiwa perkaratan besi dapat
dijelaskan dengan reaksi berikut:
 Pada
reaksi tersebut, enam elektron dilepaskan oleh dua atom besi
dan diterima oleh tiga atom oksigen membentuk senyawa Fe2O3, Oleh karena
itu, peristiwa oksidasi selalu disertai peristiwa reduksi. Pada setiap
persamaan reaksi, massa dan muatan harus setara antara ruas
kanan dan ruas kiri (ingat kembali penulisan persamaan reaksi).
Persamaan reaksi redoks tersebut memiliki muatan dan jumlah atom yang
sama antara ruas sebelah kiri dan sebelah kanan persamaan reaksi.
Oksidasi besi netral melepaskan elektron yang membuatnya
kehilangan muatan. Dengan menyamakan koefisiennya maka muatan
pada kedua ruas persamaan reaksi menjadi sama. Penyetaraan pada
reaksi reduksi oksigen juga menggunakan cara yang sama.
Pada
reaksi tersebut, enam elektron dilepaskan oleh dua atom besi
dan diterima oleh tiga atom oksigen membentuk senyawa Fe2O3, Oleh karena
itu, peristiwa oksidasi selalu disertai peristiwa reduksi. Pada setiap
persamaan reaksi, massa dan muatan harus setara antara ruas
kanan dan ruas kiri (ingat kembali penulisan persamaan reaksi).
Persamaan reaksi redoks tersebut memiliki muatan dan jumlah atom yang
sama antara ruas sebelah kiri dan sebelah kanan persamaan reaksi.
Oksidasi besi netral melepaskan elektron yang membuatnya
kehilangan muatan. Dengan menyamakan koefisiennya maka muatan
pada kedua ruas persamaan reaksi menjadi sama. Penyetaraan pada
reaksi reduksi oksigen juga menggunakan cara yang sama.
Contoh Reaksi Reduksi Oksidasi berdasarkan Transfer elektron
 Dari
persamaan tersebut, dapat diketahui bahwa Mg melepaskan elektron dan Cl
menerima elektron. Dengan demikian, Mg mengalami oksidasi dan Cl
mengalami reduksi.
Dari
persamaan tersebut, dapat diketahui bahwa Mg melepaskan elektron dan Cl
menerima elektron. Dengan demikian, Mg mengalami oksidasi dan Cl
mengalami reduksi.
Reduktor dan Oksidator
Dalam reaksi redoks, pereaksi yang
dapat mengoksidasi pereaksi lain dinamakan zat pengoksidasi atau
oksidator. Sebaliknya, zat yang dapat mereduksi zat lain
dinamakan zat pereduksi atau reduktor. Pada Contoh diatas, Magnesium
melepaskan elektron yang menyebabkan klorin mengalami reduksi.
Dalam hal ini, magnesium disebut zat pereduksi atau reduktor. Sebaliknya, atom klorin berperan dalam mengoksidasi magnesium sehingga klorin disebut oksidator.
Contoh Reduktor dan Oksidator
Reaksi Redoks Berdasarkan Perubahan Bilangan Oksidasi
Bagaimana bilangan oksidasi dapat
menjelaskan reaksi redoks? Apa Anda cukup puas dengan konsep
transfer elektron? Tinjau antara reaksi SO2 dengan O2 membentuk SO3.
Reaksinya dapat dituliskan sebagai berikut :
Jika dikaji berdasarkan konsep
pengikatan oksigen maka reaksi tersebut adalah reaksi oksidasi.
Jika dikaji berdasarkan transfer elektron maka Anda mungkin akan
bingung, mengapa? Pada reaksi tersebut tidak terjadi transfer
elektron, tetapi terjadi penggunaan bersama pasangan elektron
membentuk ikatan kovalen. Reaksi tersebut tidak dapat dijelaskan
dengan konsep transfer elektron.
Oleh karena banyak reaksi redoks yang
tidak dapat dijelaskan dengan konsep pengikatan oksigen maupun transfer
elektron maka para pakar kimia mengembangkan konsep alternatif, yaitu
perubahan bilangan oksidasi. Menurut konsep ini, jika dalam reaksi
bilangan oksidasi atom meningkat maka atom tersebut mengalami
oksidasi. Sebaliknya, jika bilangan oksidasinya turun maka atom
tersebut mengalami reduksi.
Untuk mengetahui suatu reaksi
tergolong reaksi redoks atau bukan menurut konsep perubahan bilangan
oksidasi maka perlu diketahui biloks dari setiap atom, baik dalam
pereaksi maupun hasil reaksi.
Berdasarkan diagram tersebut dapat disimpulkan bahwa:
Atom S mengalami kenaikan biloks
dari +4 menjadi +6, peristiwa ini disebut oksidasi; atom O
mengalami penurunan biloks dari 0 menjadi –2, peristiwa ini disebut
reduksi. Dengan demikian, reaksi tersebut adalah reaksi redoks.
Oleh karena molekul O2 menyebabkan
molekul SO2 teroksidasi maka molekul O2 adalah oksidator. Molekul
O2 sendiri mengalami reduksi akibat molekul SO2 sehingga SO2
disebut reduktor.
Contoh Reaksi Redoks Menurut Perubahan Bilangan Oksidasi

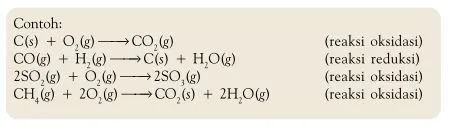

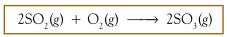











0 komentar:
Posting Komentar
Berkomentarlah yang Sopan